Добро пожаловать на сайт научно-практического журнала "Анналы аритмологии"
Эффективность метода хирургической аблации при персистирующих формах фибрилляции предсердий
Фибрилляция предсердий (ФП) является самой распространенной формой тахиаритмий. В общей популяции ее встречаемость составляет 0,5–15% на 1 млн населения в зависимости от возраста [1]. Наибольшую сложность в лечении данной патологии представляют ее персистирующая (ПФП) и длительно персистирующая (ДПФП) формы. Эффективность одной процедуры эндокардиального катетерного лечения данных форм варьирует в пределах 35–60% в отдаленном периоде [2]. Несмотря на продолжающиеся дебаты относительно эффективности применения стратегии «контроля частоты» или «контроля ритма» сердечных сокращений, восстановление и поддержание синусового ритма имеет ряд неоспоримых преимуществ в вопросе тромбообразования и вероятности развития ишемического инсульта – самых грозных осложнений ФП [3–5].
С момента своего первого применения в клинической практике в 2002 г. процедура «Maze IV» зарекомендовала себя как эффективная и простая в исполнении [6–7]. Ее эффективность в основном связана с компенсацией недостаточности трансмуральности и линейности при эндокардиальных процедурах [8–11]. Кроме того, при хирургической аблации есть возможность изоляции верхней полой вены без риска повреждения блуждающего нерва, доступна для воздействий связка Маршалла, возможна перевязка ушка левого предсердия (ЛП), возможна аблация ганглионарных сплетений [12–15].
Целью настоящей работы явилась оценка результатов клинического применения эпикардиальной биполярной аблации при хирургическом лечении идиопатических форм ПФП и ДПФП.
Материал и методы
В отделении хирургического лечения тахиаритмий НЦССХ им. А.Н. Бакулева РАМН с января 2010 по сентябрь 2011 г. методом биполярной радиочастотной хирургической аблации (БиРЧА) в условиях нормотермического искусственного кровообращения (ИК) было прооперировано 50 пациентов с идиопатическими ПФП и ДПФП. Клинико-инструментальная характеристика пациентов представлена в таблице.
|
Показатель |
Значение |
|
Количество пациентов, n |
50 |
|
Пол, м (ж) |
46 (4) |
|
Возраст, лет (M ± SD) |
54±9 |
|
Объем ЛП, мл (M ± SD) |
136,3±34,1 |
|
Данные ЭХОКГ, (M ± SD)
ЛП, см.
КДР, см.
КСР, см.
КДО, мл.
КСО, мл.
ФВ, %
Ао, мм.
МК, мм.
ТК, мм. |
46,5 ± 5,3
54,5 ± 5,6
35,5 ± 4,5
143,4 ± 26,1
53,4 ± 15,6
62 ± 7,9
25,6 ± 4,4
36,3 ± 3,02
35,4 ± 4,9 |
|
Количество неэффективных антиаритмических препаратов (ААП) |
2,2 ± 0,97 |
Таблица № 1. Клиническая характеристика пациентов. ЛП – левое предсердие, ЭХОкг – эхокардиография, КДР – конечный диастолический размер, КСР – конечный систолический размер, КДО – конечный диастолический объем, КСО – конечный систолический объем, ФВ – фракция выброса, Ао – аортальный клапан, МК – митральный клапан, ТК – трехстворчатый клапан.
В данной группе пациентов ПФП встречалась в 57% случаев (28 пациентов), ДПФП – в 43% (22 пациента). Распределение основной и сопутствующей патологий было следующим: артериальная гипертензия – 27 (54%) пациентов, ишемическая болезнь сердца – 2 (4%) пациента, сахарный диабет II типа – 2 (4%), язвенная болезнь 12-перстной кишки – 2 (4%), стеноз коронарных артерий – 2 (4%), варикозная болезнь вен нижних конечностей – 2 (4%), эмфизема легких – 1 (2%), хронический пиелонефрит – 1 (2%) пациент.
Методика хирургической аблации
Доступ к сердцу осуществлялся путем срединной стернотомии. Также стандартным образом проводилось подключение аппарата искусственного кровообращения. На параллельной перфузии проводилась дополнительная мобилизация аорты с максимальной визуализацией ее корня. После указанных подготовительных этапов начиналась непосредственно аблация субстрата ФП. Сначала проводили электрокоагуляцию и биполярную аблацию ганглионарных сплетений, окруженных слоем эпикардиального жира. На данных участках применялись как обычная монополярная коагуляция, так и аблация в биполярном режиме с применением системы Atricure (West Chester, OH, USA) (рис. 1, а, б).
После этого проводилась БиРЧА устьев легочных вен (ЛВ) также с применением биполярных зажимов системы Atricure. Минимальное число пережатий общего вестибюля ЛВ с каждой стороны было не менее 8 (рис. 1, в, г).


Рис. 1. Методика хирургической аблации: а, б – аблация заднемедиального ганглионарного сплетения (зеленой линией обозначена борозда Ватерстоуна): а – электрическая; б – радиочастотная; в – изоляция правых легочных вен; г – изоляция левых легочных вен. Ао – восходящая аорта; УПП – ушко правого предсердия; ПВЛВ – правая верхняя легочная вена; ВПВ – верхняя полая легочная вена; ГС – ганглионарное сплетение; ЛЛВ – левые легочные вены.
Далее циркулярные аблационные линии вокруг ЛВ соединяли с помощью аблационных линий, проводимых в униполярном режиме по крыше и по задней стенке ЛП (путем вывихивания сердца в рану), тем самым создавали «повреждение в виде квадрата» («box lesion») с помощью устройства линейной биполярной аблации «Cool Rail» (системы Atricure). Аблационная линия по крыше ЛП соединялась с левым фиброзным треугольником сердца трехкратной линейной аблацией в биполярном режиме для профилактики перимитральных постаблационных инцизионных предсердных тахикардий (ППТ). Далее проводилась линейная аблация от крыши ЛП к ушку, ушко перевязывалось двумя лавсановыми нитями и электрически изолировалось методом биполярной аблации (рис. 2, а).
После выполнения всех аблаций на ЛП в случае сохранения аритмии (практически всегда это уже была ППТ или типичное трепетание предсердий (ТП)), вскрывали правое предсердие (ПП) и осуществляли дополнительные воздействия. На ПП воздействия также выполнялись в биполярном режиме. После вскрытия боковой стенки ПП в биполярном режиме производили воздействия от разреза до атриовентрикулярной (АВ) борозды к передней комиссуре трехстворчатого клапана (ТК) по передней стенке, от разреза по заднебоковой стенке ПП по направлению к нижней полой вене (НПВ), от разреза на боковой стенке к ушку, электрически изолировалось ушко ПП. Далее в униполярном режиме выполнялась линейная аблация в области правого нижнего перешейка (см. рис. 2). Если аритмия сохранялась и в этом случае, то выполнялась кардиоверсия, и на этом процедура заканчивалась. После тщательного гемостаза всем пациентам подшивались эпикардиальные предсердные и желудочковые электроды для временной послеоперационной стимуляции и регистрации электрограмм.

Рис. 2. Схематическое изображение вмешательства на ЛП (а) и ПП (б): а – аблационные линии на ЛП. 1 – перевязанное ушко ЛП; 2 – ЛЖ; 3 – легочный ствол; 4 – аорта; 5 – ушко ПП; 6 – ВПВ; 7 – НПВ; 8 – коронарный синус (КС); 9 – левый фиброзный треугольник; 10 – правый фиброзный треугольник; 11 – ЛП; 12 – ПП. Пунктирной линией обозначены вы- полняемые на ЛП РЧ-воздействия; б – аблационные линии на ПП. 1 – ВПВ; 2 – ушко ПП; 3 – НПВ; 4 – овальная ямка; 5 – устье КС; 6 – ТК; 7 – устье НПВ; 8 – ПВЛВ; 9 – ПНЛВ. Сплошной крас- ной линией указаны места аблаций в биполярном режиме, пунктирной красной линией – в униполярном.
Послеоперационное наблюдение
В раннем послеоперационном периоде за время пребывания пациента в стационаре еже- дневно выполнялась трансторакальная ЭхоКГ с использованием системы визуализации «Sonos» 2500 или 5500 ультразвукового аппарата «Hewlett- Packard» (USA), оснащенного датчиком 2,5 MHz. Кроме того, ежедневно выполнялась регистра- ция электрокардиограммы (ЭКГ) в 12 стандарт- ных отведениях с использованием аппарата «MAC 1200 ST» фирмы «GE Medical Systems» (USA) и скоростью записи 25 мм/с. В случае возникновения ранних инцизионных тахикар- дий также проводилась регистрация предсерд- ных и желудочковых электрограмм.
Основным методом оценки ритма после выписки из стационара служило 7-дневное холтеровское мониторирование («Астрокард», Россия).
Послеоперационное ведение пациентов
Вне зависимости от результата всем пациентам в раннем послеоперационном периоде (3 мес) назначалась профилактическая антиаритмическая терапия (ААТ). Препаратами выбора были амиодарон, соталол в монотерапии или в сочетании с аллапинином. В обязательном порядке всем пациентам как минимум на 6 мес назначался варфарин в подобранной эффективной индивидуальной дозе с поддержанием целевого значения МНО 2,0–2,5 вне зависимости от фактического ритма сердца. В обязательном порядке проводили терапию сопутствующей патологии.
Статистическая обработка материала
Статистическая обработка материала производилась с помощью программы статистического прогнозирования в системе Statistica 10,0 (StatSoft, Inc.) в среде Windows. Непрерывные и категориальные переменные представлены в средних величинах плюс-минус стандартное отклонение в виде чисел и процентов соответственно. Для линейного отображения свободы от инцизионных предсердных тахикардий проводилось построение кривых Каплана–Мейера, статистически значимыми считались значения при уровне достоверности р<0,05.
Результаты
Средняя продолжительность койко-дня составила 14±3. Среднее время искусственного кровообращения (ИК) составило 64±21 мин. Интраоперационных осложнений не наблюдалось. Серьезных осложнений, требующих дополнительных хирургических вмешательств, не было отмечено ни в одном случае. Один (2%) пациент подвергся вентиляции легких в течение 2 сут после оперативного вмешательства вследствие дыхательной недостаточности, затем был экстубирован и переведен в отделение; у 5 (10%) пациентов на 5–8-е сутки пребывания в отделении был выявлен выпот в полость перикарда, потребовавший пункции перикарда; 2 (4%) пациентам вследствие исходной слабости синусного узла были имплантированы бифокальные пейсмейкеры.
За время пребывания в стационаре ранние ППТ были зарегистрированы у 9 (18%) пациентов. Ни в одном случае не было зарегистрировано фибрилляции предсердий (ФП). Характер и длительность цикла ППТ оценивали путем регистрации электрограммы с временных эпикардиальных предсердных электродов, и средняя длительность цикла инцизионной тахикардии составила 220±16,4 мс со средней частотой сокращения желудочков 126,4±14,2 уд/мин (рис. 3). В этих случаях назначался амиодарон. Если пациент был им насыщен, то назначалась терапия для поддержания нормосистолии.

Рис. 3. Электрокардиограмма с регистрацией эпикардиальной предсердной электрограммы во время приступа инцизионной предсердной тахиаритмии с ДЦ 280 мс. Электрограмма зарегистрирована вместо отведения V1.
Перед выпиской выполнялась наружная кардиоверсия. Однако у части таких пациентов – 5 (10%) было выполнено электрофизиологическое исследование (ЭФИ) и РЧА вследствие упорного характера аритмии и/или выявления ТП I типа на ЭКГ. Таким образом, в первые 10 дней после операции 2 (4%) пациентам была выполнена успешная интервенционная процедура по устранению ТП I типа с длительностью цикла 260 и 240 мс (во время открытой операции на ПП воздействия не проводились) и у 3 (6%) пациентов было устранено перимитральное ТП с длительностью цикла (ДЦ) 220 и 240 мс.
В первые 3 мес после операции, считающиеся «слепым» периодом, возникновение ППТ было зарегистрировано лишь у 1 (2%) пациента. Ему была выполнена эндокардиальная радиочастотная процедура, на которой было выявлено три типа аритмий (рис. 4). Пациент обратился с жалобами на учащенный базовый ритм и пароксизмы учащенного ритмичного сердцебиения. На ЭКГ и при холтеровском мониторировании были выявлены ригидный ритм с частотой 100 уд/мин и морфологией Р′-волны, практически идентичной Р-волне при синусовом ритме. Кроме того, был зафиксирован приступ ППТ. Во время ЭФИ были устранены эктопические фокусы из переднебоковой области ПП (место подшивания предсердных эпикардиальных электродов) (см. рис. 4, а) и крыши ЛП (см. рис. 4, б). Также было индуцировано ТП I типа с длительностью цикла 245 мс с последующей эффективной линейной аблацией в области правого нижнего перешейка (см. рис. 4, в).



Рис. 4. Аритмии, устраненные у пациента: а – эктопический фокус из переднебоковой стенки ПП; б – эктопический фокус из крыши ЛП; в – истмус-блок ПП.
В отдаленном периоде с максимальным сроком наблюдения 36 мес по данным периодического 7-дневного холтеровского мониторирования, выполняемого каждые 4 мес, ФП не было зарегистрировано ни в одном случае (эффективность 100%). Клинически значимые ППТ были зарегистрированы в 8 (16%) случаях. Таким образом, в указанные сроки наблюдения эффективность составила 84%. Эти пациенты находились на профилактической ААТ и антикоагулянтной терапии варфарином. На фоне приема медикаментозного лечения частота встречаемости ППТ составила 8% (4 пациента). Следует отметить, что ППТ в отдаленном послеоперационном периоде не встречались у тех пациентов, которым в «слепой» период после операции выполнялась катетерная процедура устранения ранних ППТ. В этой группе пациентов эффективность составила 100% без профилактической ААТ в те же сроки наблюдения (р=0,012) (рис. 5).
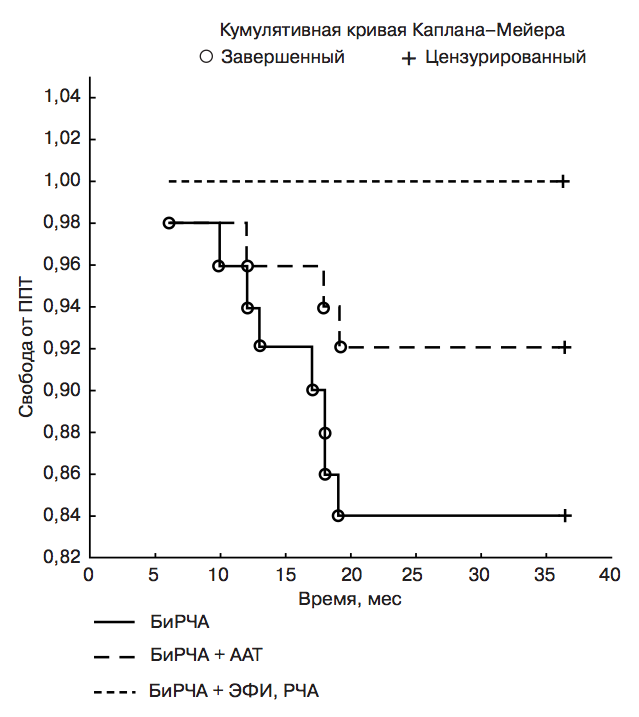
Рис. 5. Сравнительная кривая Каплана–Мейера сво- боды от ППТ в сроки наблюдения 36 мес после вы- полнения хирургической аблации (БиРЧА), приема профилактической ААТ (БиРЧА + ААТ) и выполне- ния процедуры ЭФИ и РЧА в раннем послеопераци- онном периоде (БиРЧА + ЭФИ, РЧА), p=0,012.
Обсуждение
Впервые выполненная в 1987 г. J.L. Cox операция по устранению ФП, известная как «Maze» или «Лабиринт», претерпела некоторые изменения и от травматической с использованием техники разрезов и сшиваний («cut and sew») превратилась в модифицированную с помощью криоаблации или БиРЧА, рутинно выполняемую при сочетанной клапанной и/или коронарной патологии процедуру. Упрощение процедуры в основном связано с совершенствованием технических методов для достижения трансмуральных и линейных повреждений в предсердиях. Именно отсутствие достаточности трансмуральности и линейности при катетерных методах лечения ПФП и ДПФП приводят к неудовлетворительным результатам с эффективностью в отдаленном периоде, не превышающей 40% после многократных процедур катетерной РЧА [2]. Основной критерий оценки эффективности метода хирургической аблации – это восстановление и сохранение синусового ритма в раннем и отдаленном послеоперационном периодах. Однако есть ряд и других немаловажных критериев, состояние которых на сегодняшний день не освещено в работах, выполненных с учетом достаточного количества исследуемых больных. Эти критерии включают в себя данные о смертности и инвалидизации пациентов, сократимости ЛП после массивной аблации в этой области и выключения ее задней стенки, эпизоды немых и клинически значимых эпизодов церебральных тромбоэмболий в отдаленном периоде, состоятельность лигатурных швов на ушке ЛП и, конечно, качество жизни пациентов после вмешательства. Для ответа на эти вопросы недостаточно отдельно взятых статей, а необходимо их суммирование и сопоставление в виде мета-анализов.
Кроме того, травматичность метода хирургической аблации не позволяет его применять у всех пациентов, в частности у больных с пароксизмальной формой ФП, когда основным электрофизиологическим субстратом аритмии являются мышечные муфты ЛВ, изоляция которых достижима и с помощью катетерных методик. В этом случае эффективность катетерной аблации сопоставима с хирургической и составляет около 90%, однако при условии, что линейный размер ЛП не превышает 4,5–5,0 см [2]. Триггером ФП не всегда являются ЛВ [17], а при ПФП и ДПФП необходимо выполнение линейных воздействий, и не обязательно только со стороны эпикарда, так как при персистирующей и длительно существующей персистирующей аритмиях эффективность от хирургической аблации только ЛВ составляет 60% и 15–25% соответственно [18, 19].
Определенный интерес вызывали миниинвазивные методики хирургической аблации торакоскопическим или торакотомическим доступами. Однако эффективность и безопасность данных методов до сих пор остается неясной [20].
По данным ряда авторов, общая эффективность модификаций операции «Лабиринт» в сроки наблюдения до 5 лет составляет более 80%. Упрощение процедуры в основном связано с совершенствованием технических методов для достижения трансмуральных и линейных повреждений в предсердиях. Именно отсутствие достаточных трансмуральности и линейности при катетерных методах лечения ПФП и ДПФП приводят к неудовлетворительным результатам с эффективностью в отдаленном периоде, не превышающей 40% после многократных процедур катетерной РЧА [21, 22].
Таким образом, ФП как заболевание, носящее пандемический характер в развитых странах, являющееся причиной десятка тысяч смертей от тромбоэмболий в год, а также стоимостью лечения пациентов с данной патологией, исчисляемую в миллиардах долларов, требует более радикального подхода, нежели медикаментозная терапия и катетерная аблация. И вероятность пересмотра рекомендаций с присвоением хирургической аблации более высокого класса рекомендаций при ПФП и ДПФП может иметь место в ближайшем будущем.
Заключение
Хирургическая аблация, несмотря на экспозицию и возможность выполнения практически всех аблационных линий на обоих предсердиях, не гарантирует полную свободу от ППТ в раннем и отдаленном послеоперационном периодах. В случае возникновения указанных нарушений ритма возможно выполнение эффективной катетерной процедуры даже в «слепом» периоде наблюдения и/или назначение профилактической ААТ, что, по нашим данным, может повысить эффективность хирургического метода. Более достоверный ответ могут дать лишь рандомизированные исследования на большом количестве пациентов по сравнительной оценке катетерной и хирургической аблации персистирующих форм ФП.
Конфликт интересов
Конфликт интересов не заявляется.
- Calkins H., Kuck K.H., Cappato R. et al. 2012 HRS/EHRA/ ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. A report of the Heart Rhythm Society (HRS) task force on catheter and surgical ablation of atrial fibrillation. Developed in partnership with the European Heart Rhythm Association (EHRA), a registered branch of the European Society Of Cardiology (ESC) and the European Cardiac Arrhythmia Society (ECAS); and in collaboration with the American College Of Cardiology (ACC), American Heart Association(AHA), the Asia Pacific Heart Rhythm Society (APHRS), and the Society Of Thoracic Surgeons (STS). Endorsed by the governing bodies of the American College Of Cardiology Foundation, the American Heart Association, the European Cardiac Arrhythmia Society, the European Heart Rhythm Association, the Society Of Thoracic Surgeons, the Asia Pacific Heart Rhythm Society, and the Heart Rhythm Society. Heart Rhythm. 2012; 9: 632–96.e21. PMID:22389422, DOI:10.1093/europace/eus027.
- Haissguerre M., Hocini M., Sanders P. et al. Catheter ablation of long-lasting persistent atrial fibrillation: clinical outcome and mechanisms of subsequent arrhythmias. J. Cardiovasc. Electrophysiol. 2005; 16: 1138–47. PMID:16302893, DOI:10.1111/j.1540-8167.2005.00308.x.
- Corley S.D., Epstein A.E., Di Marco J.P. et al. Relationships between sinus rhythm, treatment, and survival in the atrial fibrillation follow-up investigation of rhythm management (AFFIRM) study. Circulation. 2004; 109: 1509–13. PMID: PMID:15007003, doi: DOI:10.1161/01.CIR.0000121736.16643.11.
- Guglin M., Chen R., Curtis A.B. Sinus rhythm is associated with fewer heart failure symptoms: insights from the affirm trial. Heart Rhythm. 2010; 7: 596–601. PMID:20159046, DOI:10.1016/j.hrthm.2010.01.003.
- Pet M., Robertson J.O., Bailey M. et al. The impact of CHADS(2) score on late stroke after the Cox maze procedure. J. Thorac. Cardiovasc. Surg. 2012 [epub ahead of print]. PMID:22818126, DOI:10.1016/j.jtcvs.2012.03.087.
- Gaynor S.L., Diodato M.D., Prasad S.M. et al. A prospective, single-center clinical trial of a modified Cox maze procedure with bipolar radiofrequency ablation. J. Thorac. Cardiovasc. Surg. 2004; 128: 535–42. PMID:5457154, DOI:10.1016/j.jtcvs.2004.02.044.
- Weimar T., Bailey M.S., Watanabe Y. et al. The Cox-maze iv procedure for lone atrial fibrillation: a single center experience in 100 consecutive patients. J. Interv. Card. Electrophysiol. 2011; 31: 47–54. PMID:21340516, DOI:10.1007/s10840-011-9547-3.
- Schuessler R.B., Lee A.M., Melby S.J., Voeller R.K., Gaynor S.L., Sakamoto S.-I., Damiano R.J., Jr. Animal studies of epicardial atrial ablation. Heart Rhythm. 2009; 6: S41–5. PMID:19959142, DOI:10.1016/j.hrthm.2009.07.028.
- McClelland J.H., Duke D., Reddy R. Preliminary results of alimited thoracotomy: new approach to treat atrial fibrillation. J. Cardiovasc. Electrophysiol. 2007; 18: 1289–95. PMID:17919294, DOI:10.1111/j.1540-8167.2007.00977.x.
- Wolf R.K., Schneeberger E.W., Osterday R. et al. Video assisted bilateral pulmonary vein isolation and left atrial appendage exclusion for atrial fibrillation. J. Thorac. Cardiovasc. Surg. 2005; 130: 797– 802. PMID:16153931, DOI:10.1016/j.jtcvs.2005.03.041.
- Wudel J.H., Chaudhuri P., Hiller J.J. Video-assisted epicardial ablation and left atrial appendage exclusion for atrial fibrillation: extended follow-up. Ann. Thorac. Surg. 2008; 85: 34–8. PMID: PMID:18154774, 1DOI:10.1016/j.athoracsur.2007.08.014.
- Edgerton J.R., Edgerton Z.J., Weaver T. et al. Minimally invasive pulmonary vein isolation and partial autonomic denervation for surgical treatment of atrial fibrillation. Ann. Thorac. Surg. 2008; 86: 35–8. PMID:18573395, DOI:10.1016/j.athoracsur.2008.03.071.
- Han F.T., Kasirajan V., Kowalski M. et al. Results of a minimally invasive surgical pulmonary vein isolation and ganglionic plexi ablation for atrial fibrillation: single-center experience with 12-month follow-up. Circ. Arrhythm. Electrophysiol. 2009; 2: 370–7. PMID:19808492, DOI:10.1161/CIRCEP.109.854828.
- Bagge L., Blomstrom P., Nilsson L., Einarsson G.M., Jideus L., Blomstrom-Lundqvist C. Epicardial off-pump pulmonary vein isolation and vagal denervation improve long-term outcome and quality of life in patients with atrial fibrillation. J. Thorac. Cardiovasc. Surg. 2009; 137: 1265–71. PMID:19380002, DOI:10.1016/j.jtcvs.2008.12.017.
- Prasad S.M., Maniar H.S., Schuessler R.B., Damiano R.J., Jr. Chronic transmural atrial ablation by using bipolar radiofrequency energy on the beating heart. J. Thorac. Cardiovasc. Surg. 2002; 124: 708–13. PMID:12324728, DOI:10.1067/mtc.2002.125057.
- Khargi K., Hutten B.A., Lemke B., Deneke T. Surgical treatment of atrial fibrillation; a systematic review. Eur. J. Cardiothorac. Surg. 2005; 27: 258–65. PMID:5691679, DOI:10.1016/j.ejcts.2004.11.003.
- Schmitt C., Ndrepepa G., Weber S. et al. Biatrial multisite mapping of atrial premature complexes triggering onset ofatrial fibrillation. Am. J. Cardiol. 2002; 89: 1381–7. PMID:12062732, DOI:10.1016/S0002-9149(02)02350-0.
- Cox J.L. The central controversy surrounding the interventional-surgical treatment of atrial fibrillation. J. Thorac. Cardiovasc. Surg. 2005; 129: 1–4. PMID:15632817, DOI:10.1016/j.jtcvs.2004.08.049.
- Li H., Li Y., Sun L. et al. Minimally invasive surgical pulmonaryvein isolation alone for persistent atrial fibrillation: preliminary results of epicardial atrial electrogram analysis. Ann. Thorac. Surg. 2008; 86: 1219–25. PMID:18805165, DOI:10.1016/j.athoracsur.2008.04.081.
- Barnett S.D., Ad N. Surgical ablation as treatment for the elimination of atrial fibrillation: a meta-analysis. J. Thorac. Cardiovasc. Surg. 2006; 131: 1029–35. PMID:16678586, DOI:10.1016/j.jtcvs.2005.10.020.
- Бокерия Л.А., Ревишвили А.Ш. Хирургическое лечение тахиаритмий. В кн.: Бокерия Л.А., Голухова Е.З. (ред.) Клиническая кардиология: диагностика и лечение. В 3 т. М.: НЦССХ им. А.Н. Бакулева РАМН; 2011: 222–44. eLIBRARY.RU:20414982.
- Бокерия Л.А., Ревишвили А.Ш., Рзаев Ф.Г., Сергуладзе С.Ю. Хирургическое и интервенционное лечение фибрилляции предсердий. Вестник РАМН. 2009; 12: 21–9. eLIBRARY.RU:13016906.





